不同处理方法后的全血样本细胞计数,您get到了吗?
发布日期:2021-03-23 14:29:00浏览次数:3569
从全血中提取细胞样本是一个常用的实验技术手段,因为这类样本能模拟人体或动物的真实细胞环境。相对于下游的实验例如药物筛选、功能研究等会比单纯的细胞系会有更好的实验效果。
从血液中提取细胞最重要的一步就是去除红细胞。以成年人外周血为例,其各种细胞的数量及比例如下表所示:

红细胞数量巨多,为了下游实验能制备好的细胞样本必须去除红细胞。目前常用去除红细胞有以下几个方法:
1.氯化铵裂解法:
它既不损伤有核细胞又能充分的去除红细胞。这种方法简单易行且比较温和的红细胞去除方法,主要用于经酶消化分散的组织细胞的分离纯化,淋巴细胞的分离纯化以及组织细胞蛋白与核酸提取等实验中红细胞的去除。经红细胞裂解液裂解得到的组织细胞中不含红细胞,可进一步用于原代培养、细胞融合、流式细胞分析、核酸与蛋白的分离和提取等。但是裂解后红细胞碎片较多,不易去除。
2.低渗裂解法
利用细胞渗透作用原理,细胞在低浓度缓冲液中会渗透吸水导致红细胞破裂,而白细胞相对红细胞有一定的耐受压,可以达到分离的目的。但是低渗法也能对白细胞有一定损伤,会对后续功能实验有影响。
3.密度梯度离心
常用的两种介质是Ficoll和PercollTM 。Ficoll是蔗糖的多聚体,常用于外周血单个核细胞的分离。Percoll是二氧化硅胶体颗粒,可形成连续和不连续两种梯度,主要能分离细胞,亚细胞结构和病毒的分离。密度梯度离心分离能更好的去除杂细胞获取目的细胞,且不会损伤细胞在下游分析中的功能或性能;常用于分选及功能实验;该方法效果好但是耗费时间长。全血样本经细胞提取后用于下游实验时,精确的细胞计数是细胞实验中至关重要的一步。因此需要对总的有核细胞和活细胞都要进行计数。虽然台盼蓝染色法是常用的活细胞计数方法,但是对于含有红细胞、血小板和杂质的样本,台盼蓝染色法不能区分计数有核细胞、红细胞和杂质。如果想快速精确计数有核细胞且进行精确细胞活力分析,那么Countstar双荧光AO/PI细胞计数法必不可少,它能保证计数结果的准确性和重复性。

Countstar细胞分析仪还能对全血样本直接计数分析。实验过程如下:
1) 取 20µL 血液样品并用180µL PBS 稀释。2) 取 12µL AO/PI 染色液加入12µL 样品中,用移液器轻轻混合;5)将计数板放入 Countstar® FL 仪器;6) 选择“AO/PI 活率”测定,然后输入此样品的样品ID。7)选择稀释比率和细胞类型,点击“运行”开始测试。
结果
1.全血的明场图像
在全血的明场视野图像中,有核细胞淹没在红细胞中不可见。图1

2.全血的荧光图像
AO 和 PI 染料都能对细胞核中的DNA 染色。因此,血小板、红细胞或细胞碎片的存在不会影响白细胞浓度和活率结果。活细胞(绿色)和死细胞(红色)很容易在荧光图像中看到(图2)。
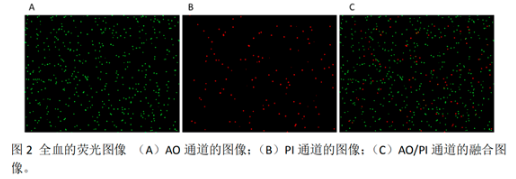
3.白细胞的浓度和活率
Countstar® Rigel 软件自动对每个样品的三个视野进行细胞计数,并计算白细胞总数(1202)、浓度(1.83x106细胞/ ml)和活率(82.04%)的平均值。全血图像和数据以PDF、图片或Excel 格式导出进行其他分析或数据归档。

在不裂红时对全血进行有核细胞计数可计算有核细胞的回收率。采用荧光计数法对分离后的样本能有效排除细胞碎片、红细胞等杂质影响,从而达到精确计数目的。





