微载体培养的细胞如何计数
发布日期:2021-04-30 17:03:21浏览次数:3357
细胞培养技术是研究动物细胞结构、功能、分化、以及生产许多重要的生物物质,如疫苗、酶类、激素、抗体、干扰素和核酸等所必需的技术。微载体系统提供的极大的培养表面积/体积比,是一种更高产的细胞培养方式,为动物细胞生长提供了便利的表面或者提高了标准单层培养容器和灌注室的细胞产量。微载体生物反应罐培养技术具有最充分利用培养空间、细胞产量高、培养条件易控制、操作标准化和有效控制污染等优点,该技术在生物技术产品规模化生产中具有很大的潜力,已经成功运用于疫苗等规模化生产。目前碰到较多的微载体培养体系分为两种,一种是球状微载体培养,另外一种是固定微载体。这两种微载体培养方法的细胞在微载体上呈3D模式生长。
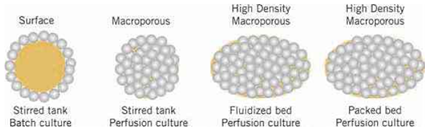
图1、不同微载体及应用
细胞浓度计数是细胞培养过程中的重要一环,常规的细胞计数方法是将细胞制成细胞悬液,采用图像法借助经典的台盼蓝染色原理或者荧光AO/PI染色原理进行细胞浓度、活率的检测。
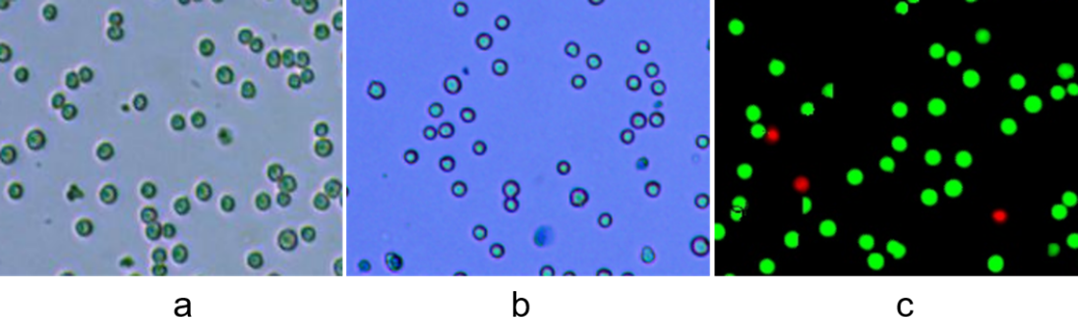
图2、a明场细胞计数,b台盼蓝染色细胞计数,c荧光AO/PI计数,Countstar检测图片
不同染色原理适用于不同细胞类型,常规细胞系、肿瘤细胞等传代培养的细胞,仅检测细胞浓度不需要监测活率大小,可以直接采用明场计数不需要台盼蓝染;这类细胞需要检测活率台盼蓝方法就可以满足需求。如果是原代细胞、干细胞、PBMC等成分较为复杂的细胞则需要借助荧光AO/PI双染的方法才能实现活、死细胞的准确计数。
微载体培养的这种呈3D模式生长的细胞如何实现细胞浓度的计数呢?不论使如何培养的,需要准确检测细胞浓度还是需要将细胞制成单分散的悬液。常规贴壁培养的细胞是采用胰酶消化细胞,胰酶对台盼蓝和荧光计数是没有影响的,但是微载体培养的细胞常规的胰酶是没办法完全消化的,胰酶消化微载体培养的细胞计数如下图3,大多数细胞还是黏附在微载体上,会导致计数结果偏低。
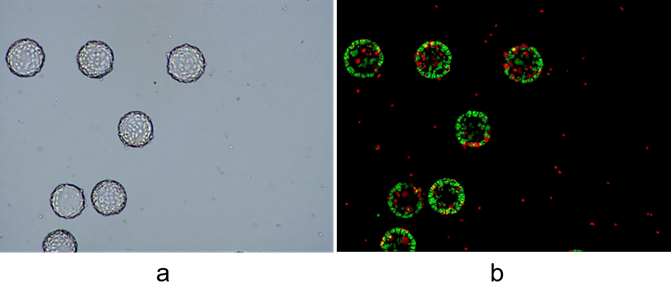
图3、胰酶消化微载体培养细胞,a明场计数、b 荧光场AO/PI计数
为避免微载体黏附细胞的损失,目前已经成熟的方法是采用含有TritonX-100成分的裂解液使细胞裂解,得到裸核细胞,通过对裸核细胞的计数实现原始浓度的检测。但是TritonX-100是一种非离子表面活性剂,会使脂质溶解增加抗体对细胞膜的通透性,帮助蛋白酶的分解。采用这种裂解液裂解后的细胞,不论是采用台盼蓝或者荧光方法均无法
实现细胞浓度的计数,台盼蓝会受TritonX-100影响结成絮状如下图4a,而荧光AO/PI会发生荧光猝灭,导致荧光场中检测不到荧光信号结果如下图4b。

图4、台盼蓝和AO/PI检测裂解后的细胞,a台盼蓝计数结果,b荧光计数结果
针对这种裸核细胞粒径又小有无法染色,我们Countstar Rigel内置“细胞计数”模式,可以不需要染色液实现细胞浓度的检测。如下图5采用细胞计数程序不染色直接计细胞总浓度,视野中细胞轮廓清晰,标记图中无杂质干扰。细胞计数程序检测该细胞重现性三次计数结果总浓度CV=5.17%,重现性好,解决了裂解后细胞浓度计数的难题。
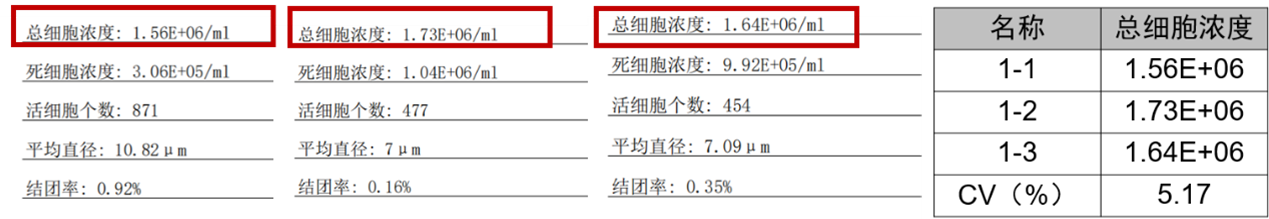
图5、纸片微载体培养的vero细胞裂解后Countstar Rigel的计数结果