合规?还是不合规?得看这几点!
发布日期:2021-05-28 08:51:00浏览次数:2661
在快速发展的制药和生物行业中,GMP是对企业生产过程的合理性、生产设备的适用性和生产操作的精确性、规范性提出强制性要求。它是为保证药品安全有效、质量一致、符合标准,适合其使用目的而推行的一种行之有效的科学化、系统化的管理制度,也是保证药品质量的关键所在。它最早源于美国,是欧美国家在制药行业中通用的标准,是对药物生产过程中的人、设备、用料、供应商监控的标准。
Countstar与GMP验证
为了适应现代生物制药的需求,Countstar细胞分析仪符合GMP法规要求,能满足客户从实验室到生产过程的细胞质量控制需要,帮助客户提高工艺效果和可预见性。
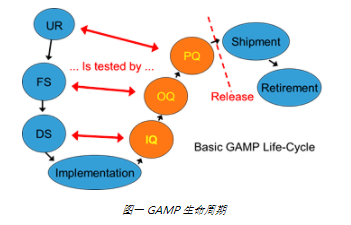
在Good AutomatedManufacturing Practice良好自动化生产实践指南中,UR(用户需求说明)、FS(功能说明)、DS(设计说明)可以与3Q验证相对应,符合GAMP验证生命周期的概念和方法。
IQ(Installation Qualification)安装确认,确认仪器文件、部件及安装过程,确保仪器在目标环境中安装。
OQ(Operational Qualification)运行确认,确认仪器生产工艺环境条件下进行功能确认,验证包括验证并记录 Countstar 细胞计数仪的系统的可靠性、稳定性和安全性等主要功能。
PQ(Performance Qualification)性能验证,PQ 验证过程与 OQ 验证相关,用于记录特定过程在一段时间内的性能来确保持续的产品质量。

GMP对设备的规定除了设备的设计方案应合乎生产加工工艺的规定外,最重要的标准是设备应能避免交叉污染,设备自身不危害产品品质和生产环境,并有利于清理和维护保养。
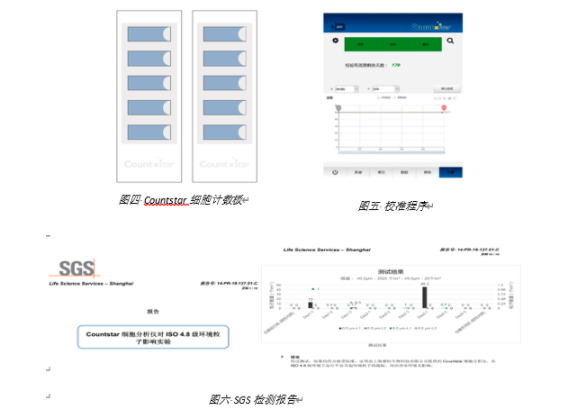
Countstar采用一次性细胞计数板,一次自动检测5个样本,避免交叉污染,同时是一款免维护的产品,定期完成校准即可。
SGS检测报告显示仪器的运行不会引起GMP环境的粒子超标。
综上,Countstar可以提供贯穿于整个验证生命周期中的知识、经验、文件和服务。
Countstar与FDA 21 CFR Part 11
21 CFR Part 11从1997年颁布以来已被推广至全球,虽然没有强制性,但被欧洲、亚洲等地图和国家普遍接受和使用。作为美国的法律,被美国的生物医药企业、医院、研究所和实验室广泛接受和遵照执行。如果一个企业的药物、生物医药相关设备或者信息系统不符合21 CFR Part 11的规定,FDA能够能根据规定剥夺出口到美国的权利。
Countstar是如何符合21 CFR Part 11的?
1)确保系统能够检测更改的记录,Countstar软件可对任何修改,编辑,删除,调节等做出详细的记录。
2)产生人可读的电子形式的精确记录,Countstar软件记录在这台机器上的任何操作,同时可以导出只读的PDF报告。
3)电子记录可以检索和获取,Countstar软件记录的电子记录不可被删除,可以进行关键字或者时间进行检索。
4)对独立用户的使用权限进行控制
Countstar软件有三级用户管理权限,可对不同层级的用户进行授权。
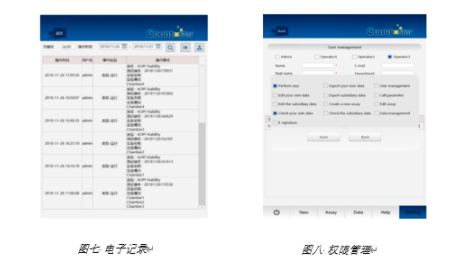
5)确保对用户所做的所有操作进行审计跟踪,并且不删除任何记录,Countstar软件上的电子记录不可被删除,包括管理员。电子记录包括日期,时间,用户名,机器序列号以及用户所做的操作。
6)所有的步骤和事件按照可控的顺序进行,Countstar是全自动的仪器,所有的数据采集和软件操作步骤均是按照设定好的顺序进行。
7)控制数据输入的来源是确定的,被授权的用户可以操作Countstar软件,使用预设好的程序进行,所有操作步骤都是来源确定的。
8)对使用者进行适当的培训,Countstar软件中有用户手册,里面包含快速操作指南和仪器使用说明。
9)对数据中的电子签名需要明确的定义,Countstar 软件的数据库中的每一条记录均有操作者的信息,包括真正姓名,部门,邮箱,联系方式等。

Countstar细胞分析仪是符合GMP和FDA21 CFR Part11 的合规仪器,满足抗体、细胞治疗、干细胞和生物制药企业等现代化生产和发展的需要。