细胞活率检测的秘密,你真的清楚吗?
发布日期:2021-11-02 14:16:00浏览次数:5265
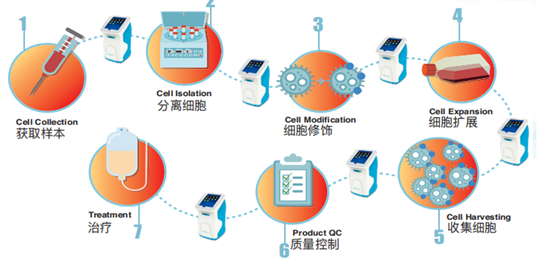
最近十几年,随着细胞治疗产品研发技术的快速进步,细胞治疗已经成为治疗不同癌症的主要方式之一。细胞治疗的最终产品是改造后的免疫细胞或者干细胞等,因此细胞活率的测量至关重要。如若有误,将会导致病人在免疫治疗中无效,甚至引起自身免疫反应。细胞活率是细胞治疗产品生产和放行的基本测量指标之一。在细胞治疗产品中,活细胞太少可能会降低产品的有效性;死细胞、濒死细胞和细胞碎片可能会引发不必要的免疫反应。因此,对细胞治疗产品中的活细胞、死细胞或濒死细胞浓度的有效测定至关重要。活率检测可以作为确定细胞治疗产品的强度或剂量的方法,并作为细胞毒性检测的一部分,用来评估细胞治疗产品的效力。除了在产品表征和放行检测中需要评估细胞活率外,活率的测量也可以作为过程控制的指标之一,为整个生产过程的决策提供关键信息(如图1)。
图1(图片来源于网络)
面对现有的细胞活率测量原理、方法和检测仪器多种多样,以及评估细胞活率的目的各不相同,细胞治疗行业亟需更为严格的方法来选择、设计和控制细胞活率测量。根据美国国家标准与技术研究院(NIST,简称美国国家计量院)对细胞活率测量的探讨,细胞活率测量需要明确的问题主要有以下三个:
1.细胞活率,我们真正测量的是什么?
2. 我们选择的测量方法如何影响活率结果?
3. 如何建立质量控制标准?
01.活率测量,我们测的是什么?
活率测量通常是一个瞬时行为,可以理解为捕获了细胞在活和死的连续过程中,某一瞬间的离散信息。细胞样本的活率可能随时间或样品制备过程而改变,死细胞和污染碎片可能会增加,或在测量过程中由于细胞粘附到离心管壁或移液管而导致活细胞或死细胞单方面或大比例丢失,从而影响活率的计算。例如,在流式细胞术染色过程中进行的样品清洗步骤可能会去除部分失活细胞群而导致活率测量偏高。
测量方法本身也会影响细胞活率的检测结果。目前,使用最广泛的图像智能分析法,确定细胞活率时,主要是通过直接计算出样本中总细胞、活细胞和死细胞的数量。这种情况下细胞活率并不是一个测量值,而是通过计算活细胞数占总细胞数的比例获得。例如,台盼蓝染色法会分别计数活细胞(明亮的中心)和死细胞(深蓝色)(图2),再计算活率,使用公式为:

图2.
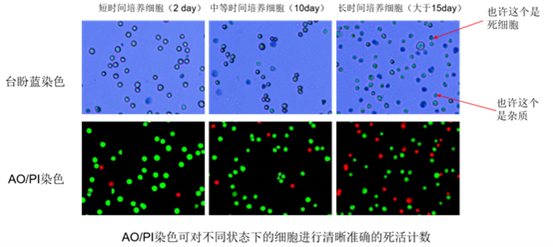
目前,细胞计数主要方法为图像智能识别法和库尔特—电阻法,而图像智能识别法是目前市场上主流的细胞计数法。在此基础上,针对细胞活率的测量,主要有台盼蓝染色和荧光染色法。台盼蓝长期以来一直是测定死细胞存活率的金标准。这种染料不能进入细胞膜完好的活细胞,但可以进入细胞膜受损的死细胞并富集,使细胞呈深蓝色。多年来,在没有科学支持的情况下,台盼蓝对80%以下的细胞存活率是不准确的。近年来随着细胞治疗行业的进步,台盼蓝染色原理已经不能满足复杂的细胞样品的计数,比如原代细胞中的碎片、PBMC中残留的红细胞血小板等杂质碎片、培养后期的细胞,尤其在干细胞、CAR-T、NK等细胞治疗领域台盼蓝计数方法的缺陷尤为突出(如图3)。

图3.
随之衍生出的AO/PI荧光计数方法(前几期有普及过),采用核酸特异性标记原理,AO(吖啶橙,小分子染料,488激发,525发射)标记细胞核酸发绿色荧光;PI(碘化丙啶,大分子染料,535激发,600发射)标记死细胞核酸发红色荧光,根据活死细胞荧光不同直接排除杂质碎片的干扰,弥补了台盼蓝的不足。AO/PI荧光计数方法在干细胞、CAR-T、NK等细胞治疗领域广受科研工作者的喜爱(如图4)。
图4.
由此可见,如果细胞计数结果由于测量方法而受到干扰,则活率结果也会受到显著影响。而为了提高细胞样本中活细胞计数的准确性,可以利用荧光核染色排除红细胞、血小板等无核细胞和细胞碎片的计数。荧光细胞核染料,如吖啶橙(AO)和碘化丙啶(PI)可以提高对活细胞和死细胞判断的准确性,从而提高活率计算的一致性。细胞活率测量的一般工作流程可以归纳为几个关键步骤:该过程中的每个步骤都会给测量结果带来差异。引起差异的来源和差异的水平取决于细胞样本的属性以及活率测量方法的类型。控制策略通常会在测量过程中的特定节点实施一种技巧性的操作,用于提高测量结果的置信度。取样是细胞活力测量过程中的重要步骤。在此步骤中,通常会从较大体积的细胞中取样一小部分细胞。如果在此步骤中混匀和移液的操作不当,则用于活率测量的测试样本可能无法代表原本大体积的样本,从而破坏了活率测量的相关性。如果细胞样本中存在聚团,则可能会影响取样,就需要在样本制备和数据分析过程中增加其他步骤以解决聚团问题。在这些情况下,控制样本中的细胞聚团很重要,而且监测聚团细胞百分比可以提示使用者注意测量条件是否存在问题。样本制备是引起测量差异的另一个重要来源,由于涉及许多手动步骤,通常难以控制。此外,试剂和耗材(例如计数板)也会影响测量质量。样本制备还可能引起样品属性的变化。任何导致细胞死亡的样本制备步骤对于活率测量尤其成问题,应进行控制以在整个测量过程中保持样本的稳定性。数据收集和数据处理与分析,目前最适用的是使用自动化或半自动化的细胞计数仪进行收集和处理。传统的血球计数法,人为误差太大,早在1964年统计学家Fruend和Carol就发表文献指出不同操作者检测同一样本的计数差异可高达52% ;同一操作者不同次计数间的差异也可达到20%。相对而言,仪器的误差相对较小。为确保仪器测量的可信度,常规的仪器验证和维护必不可少;同时,在基于图像智能分析法的细胞活率测量中,图像质量,特别是聚焦和图像亮度会影响细胞活率测量。在运用自动图像分析算法之前,图像必须达到足够高的质量,这一点至关重要(如图5)。
最后,运用商品化的参考微珠,可用于建立细胞活率测量中的控制策略。参考微珠的优点是稳定性好,可以在市场上买到,而且在不同实验室之间可以保证品质的均一。微珠材料可用于建立仪器验证方法。模拟细胞属性的新型合成参考材料也可以用作测量过程控制,以解决由过程(例如细胞染色)和数据分析(例如细胞设门)引起的差异性来源(如图6)。
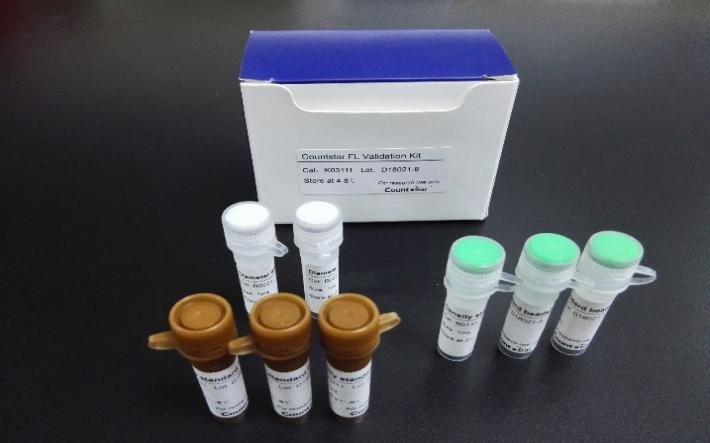
近年来,随着细胞治疗产品在癌症治疗领域的日益突出,合适且可靠的细胞活率测量变得至关重要。Countstar 荧光细胞计数仪能够提供不同的细胞活率测量方法(台盼蓝染色和AO\PI核酸染色),满足用户对不同测量方法的需求。此外,自动化的测量操作(减少人为误差)、高质量的CCD镜头(确保高质量的图像),定制化的标准微珠(性能验证)可为您的细胞活率测量保驾护航!