【反馈有礼】小肠类器官培养知多少
发布日期:2022-07-29 10:32:00浏览次数:3656
小肠类器官
小肠类器官作为模拟体内小肠上皮的体外培养模型,自2009年Hans Clevers团队成功构建以来,目前已在肠道感染性疾病模型建立、组织和器官再生、精准医学领域、肿瘤学、药理学和营养学的研究中得以应用。
构建小肠类器官的意义
小肠作为人重要的器官之一,执行着消化、吸收、分泌、免疫屏障等多方面的功能,肠道疾病的发生也与肠道屏障的破坏有关。与传统实验模型(细胞系2D培养及动物模型)相比,肠道类器官具有多种优势。2D结构缺乏组织结构和复杂性,类器官模型在组织和结构上与原代组织更相似。体外构建的肠道类器官模型包含所有类型的肠上皮细胞,并具有水、离子吸收和转运等生理功能,这些优势是单一细胞系所无法比拟的。类器官模型也可以作为连接2D培养和动物模型的桥梁,此外,动物模型与人类存在较大的种属差异,无法完全模拟人体肠道的真实生理反应,而来源于人体组织的肠道类器官能够更加准确的反应人体的生理及病理变化。
如何构建小肠类器官
肠道类器官目前有三种构建方法:
1、2009年Hans Clevers团队首次利用小鼠LGR5+小肠干细胞在体外培养出小肠类器官。
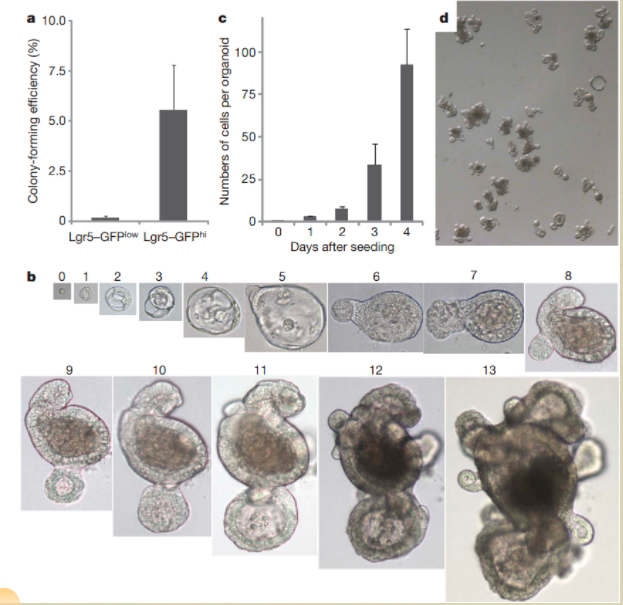
利用小肠干细胞培养出小肠类器官需3-7天时间。将小鼠肠段中分离出来的隐窝细胞培养在含有ENR(EGF、Noggin、R-spondin)的三维Matrigel培养体系中,发现该培养体系下隐窝细胞能够形成类似于肠的微型结构,即隐窝-绒毛样复合体。他们也利用了该培养体系对前期分离并鉴定出来的单个Lgr5+肠干细胞进行培养,发现也能形成具有上述特殊结构的类器官;同时,他们追踪实验表明,该类器官仍具有Lgr5+肠干细胞的存在,所以该模型能够很好地模拟体内小肠的形态结构和功能。
成功的从单个GFPhi培养成功的小肠类器官,显微镜4倍物镜放大后,从第1天的单个细胞到第十三天成熟小肠类器官不同天数拍摄的组织图片。
2、2011年Spence等应用多能干细胞或胚胎干细胞培养成人肠道类器官。
这是世界首例证明人类 PSC 可以有效地在体外分化成具有与胎儿肠道非常相似的三维结构和细胞组成的人体组织的报道。此外,PSC衍生的人体肠组织可以在体外成熟,发育肠干细胞并获得吸收和分泌功能。此模型后续可以用来研究肠道干细胞和药物设计研究、先天性肠道缺陷研究、组织移植等。利用一系列生长因子,涉及到激活诱导的决定性内胚层(DE)形成的因子,FGF/Wnt诱导的后内胚层模式,后肠规范和形态发生; 以及促进肠道生长、形态发生和细胞分化的前肠道培养系统。 由此产生的三维肠道“类器官”包括一个极化的柱状上皮,该上皮形成绒毛状结构和表达肠干细胞标志物的隐窝状增殖区,含有功能性肠细胞,以及杯状、Paneth和肠内分泌细胞。 一般利用iPS或ESC干细胞培养类器官需要1-2个月甚至更长时间。
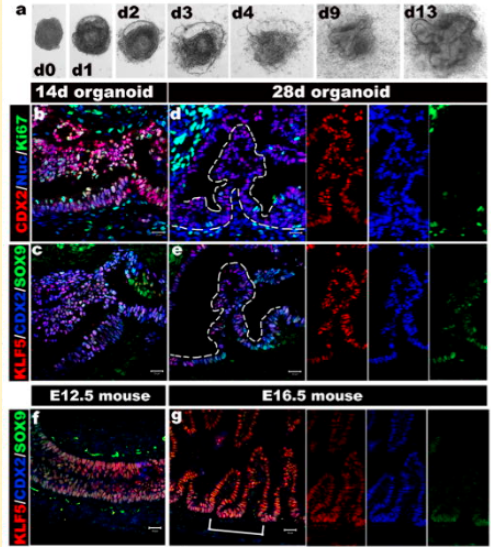
图2丨hESCs和hiPSCs形成三维的肠类器官
13天后形成高度复杂的被间充质组织包围的上皮结构的类器官;培养14、28天后的类器官连续切片(连续切片为b、c、d、e)上的肠转录因子(KLF5、CDX2、SOX9)的表达和细胞增殖情况(连续切片为b、c、d、e)。f、g、e为14.5天的小鼠胎肠KLF5、CDX2、SOX9表达情况 。
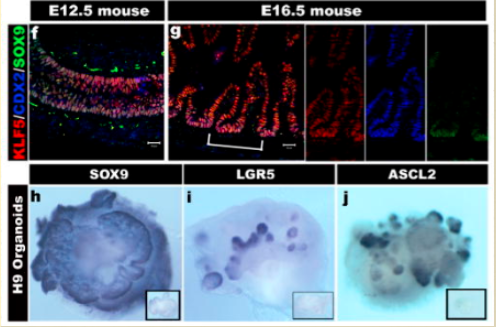
图(f)和E16.5 (g)类似于发育中的肠道类器官,其中右侧小的图片显示d、e、g、h、i和j的不同颜色通道。培养56天龄的类器官的原位杂交结果显示Sox9的上皮表达(h)和干细胞标记物Lgr5 (i)及Ascl2 (j)的限制性“隐窝样”表达。
3、2017年Miura和Suzuki直接应用再生技术将分化的体细胞转化为肠道类器官。
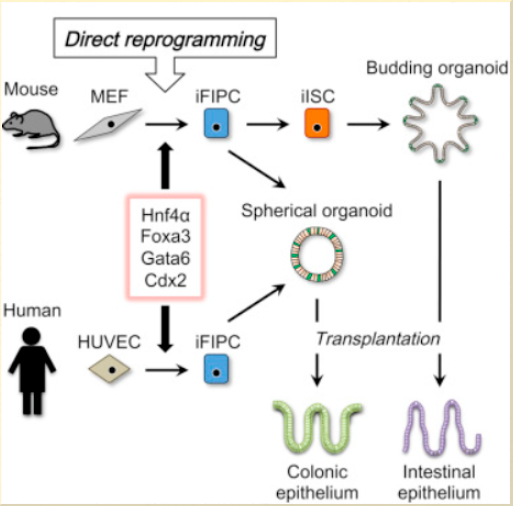
Miura 和 Suzuki 描述了将小鼠成纤维细胞直接转化为类似于胎儿肠源性祖细胞的细胞,这些细胞可以产生肠干细胞类器官并在移植后重建受损的结肠组织。他们还研究证明,类似的方法可以用于制造人类诱导的肠道祖细胞。利用重组编程技术将Hnf4α、Foxa3、Gata6和Cdx2引入小鼠胚胎成纤维细胞或人脐静脉内皮细胞(HUVEC),可以将其转化为诱导的胎儿肠源性足细胞(iFIPC),iFIPC可形成球形类器官,移植后,诱导的球形和出芽的类器官分别能重建结肠上皮和肠上皮。这种产生肠道类器官的方法可能会很好地促进疾病分析和治疗开发的应用。
图3丨利用小鼠MEF细胞或人huvec诱导形成三维的类肠器官
小肠类器官的构建和传代方法
小肠隐窝的分离、 培养、小肠类器官传代、冻存及复苏的方法。
本方法来自文献小肠类器官的构建及传代培养 [J]. 中国比较医学杂志, 2021, 31(1): 1-6.
小肠类器官的分离
新鲜取出小鼠小肠,用冰DPBS将肠内容物清洗干净,刮去小肠绒毛,收集后清洗干净,加入2.5mmol/L的EDTA,冰上震动消化30min,然后用润湿的移液器轻柔的吹打3次,将吹打后的溶液过70μm的滤网到50mL锥形管中,标记为第1管,重复上述步骤依次标记2、3、4、5管。镜检保留小肠隐窝较多且杂细胞较少的管。将目标管放于离心机中,4℃、1200r/min离心5min,弃上清,沉淀在10mL 15% BSA/DPBS溶液中重悬,离心3次重悬后取10μL悬液计数,并计算离心管中的隐窝总数。
小肠类器官的培养
以1μL基质胶12.5个隐窝计算应加入的基质胶体积,在离心管中用移液器重悬肠隐窝,用移液器吸取50μL悬液,一次性打入到在培养箱中孵育过的24孔板中,种板后将24孔板放于培养箱中孵育30min至基质胶完全聚合。待基质胶完全聚合后沿孔壁添加500μL类器官生长培养基。24孔板放于37℃、5% CO2培养箱中培养,每2~3d(培养基变黄)更换培养液。
小肠类器官的传代
培养7~10d或类器官中央变黑时可以传代,提前将24孔板放于培养箱中预孵育至少30min。吸走待传代孔的培养液,每孔中加1mL冰DPBS,1min后挑起基质胶,用1mL枪头将基质胶轻轻吹散,用配备27½G针头的1mL注射器一次性吸走悬液,重复操作1次,将悬液加入5mL离心管中,1200r/min,4℃、离心5min,离心,弃上清,按每孔1∶3传代。
小肠类器官的冻存
选择生长状态良好的类器官(一般传代后3~4d),进行冻存,每两孔冻存一管。吸去培养液,加入1mL细胞冻存培养液,用1000μL的枪头将基质胶吹散,后将悬液加到细胞冻存管中,放于冻存盒中,于-80℃冰箱放置1d,后转入液氮长期保存。
小肠类器官的复苏
预先将24孔板放于培养箱预孵30min。取出液氮中的冻存管,放于37℃水浴锅中,当冻存液刚好溶解时取出,用配备27½G针头的1mL注射器抽吸一次,然后将细胞悬液转移到15mL离心管中,于1200r/min、4℃的离心机中离心5min,弃上清,加入5mL冰DPBS重悬,重复上述离心步骤,弃上清。按照之前类器官培养的步骤铺板和培养,每冻存管小肠类器官传4孔。
Countstar Mira BF
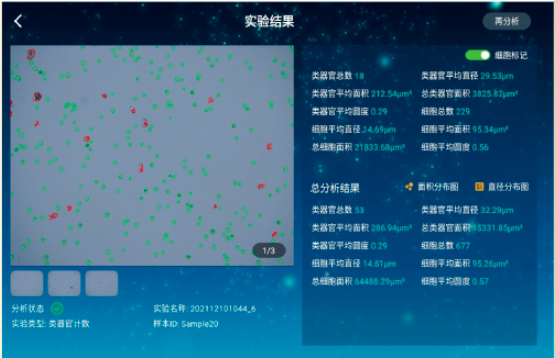
对小肠类器官生长状态检测
对消化后的小肠类器官进行计数
类器官分析
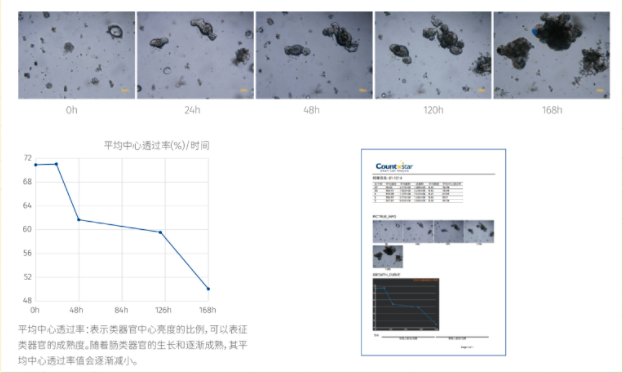
连续观察小鼠小肠类器官生长状况
通过对生长过程中类器官进行拍照分析,得到中心透过率、个数、平均面积等指标进行统计,为生长过程及成熟度提供数据支撑。
对于类器官分析,
我们还在路上并一直在努力,
希望能与类器官行业及广大客户共同进步
并期待为大家提供技术支持。
反馈有礼
你对小肠类器官的培养有哪些问题、见解?
对Countstar又有哪些期许呢?
欢迎广大实验室工作者留言哦~