你真的会用血球计数板吗
发布日期:2021-06-21 10:42:00浏览次数:6587
血球计数板计数细胞浓度和活率是一个比较常规简单的方法,但是您真的会用吗?下面小编跟大家聊聊如何正确使用血球计数板。
血球计数板计数室一览
血球计数板用优质厚玻璃制成。每块计数板由H形凹槽分为2个同样的计数池。计数池两侧各有一支持柱,将特制的专用盖玻片覆盖其上,形成高0.10mm的计数池。计数池放大后如下图1所示

哪里是我们进行计数的区域
整个网格区域分为9个大方格,其中四角及中间大方格为我们的计数区域,我们根据大方格中小方格数分两种:如下图2黄色区域和下图2蓝色区域,两个区域计数体积相等,计数体积为1mm*1mm*0.1mm=1/104ml;其中黄色区域又平均分25个较小方格,通常为了减少工作量,只计数其中5个更小的方格,如下图2亮黄色区域;蓝色计数区域则平均分为16个较小的方格。
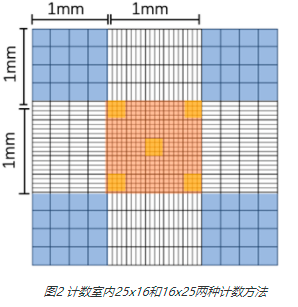
如何不同区域细胞进行计数
16小方格的蓝色和25小方格的黄色计数区,长宽都是1mm,盖玻片覆盖在计数池上方形成0.1mm深度的空间,我们可以得出两个区域可以充满的液体体积为:1mm×1mm×0.1mm=1/104ml,细胞浓度=#cell/ml=测量区域细胞个数/测量区域体积×稀释倍数=测量区域细胞个数×104×稀释倍数。下面我们分别总结下不同的方格计算公式:
25小方格计数区计算公式:
1、如果计数的是1个如上图2所示整个黄色区域:#cell/ml=细胞个数×104×稀释倍数:
如何选择最合适的计数区进行计数
根据细胞密度判断,如果密度比较小,可以计数蓝色区域大方格,如果细胞密度适中,可以计数蓝色区域16个大方格中的一个,如果细胞密度较小,则计数黄色区域25方格中的较小方格,但是无论选择哪种方式计数,每个方格中至少有20-50个细胞来计数;细胞密度过高,往往会更容易造成操作者疲劳增加出错概率,故建议每个方格中最多计数100个左右细胞为宜。
总结
1、保持计数板及盖玻片清洁干燥;
2、保持稳定的计数小室:先加盖专用的盖玻片(比普通盖玻片厚一些),形成稳定的计数室,一次性充满计数室,减少多余细胞液溢出导致的误差,这里一般加样10微升;